
説明文の1
トロポニンTは筋肉の収縮・弛緩を調節する重要な役割を果たしている。また、そのアイソフォームは、筋特異的に、また発生段階特異的に発現している。それゆえのアイソフォームの間に、筋肉の収縮・弛緩を微調節するための機能の相違があることが推定される。しかし、本当に各々のアイソフォームは異なる機能をもつのだろうか?これまでは遺伝子に関する内容が主であったが、実際に働くのは蛋白質である。トロポニンTアイソフォームの間に機能の相違があり、その分布は筋肉の収縮特性の相違をもたらすために能動的に決定されているならば、トロポニンTアイソフォームは機能的な特異性(Functional Specificity)をもつことになる。一方、トロポニンTアイソフォームの間に機能の相違がなく、その分布は筋肉の収縮特性とは関係なく、発生のなりゆきとして受動的に決定されているならば、トロポニンTアイソフォームは機能的な冗長性(Functional Redundancy)をもつことになる。Functional Specificityなのか、Functional Redundancyなのか、明確にする必要がある。
説明文の2
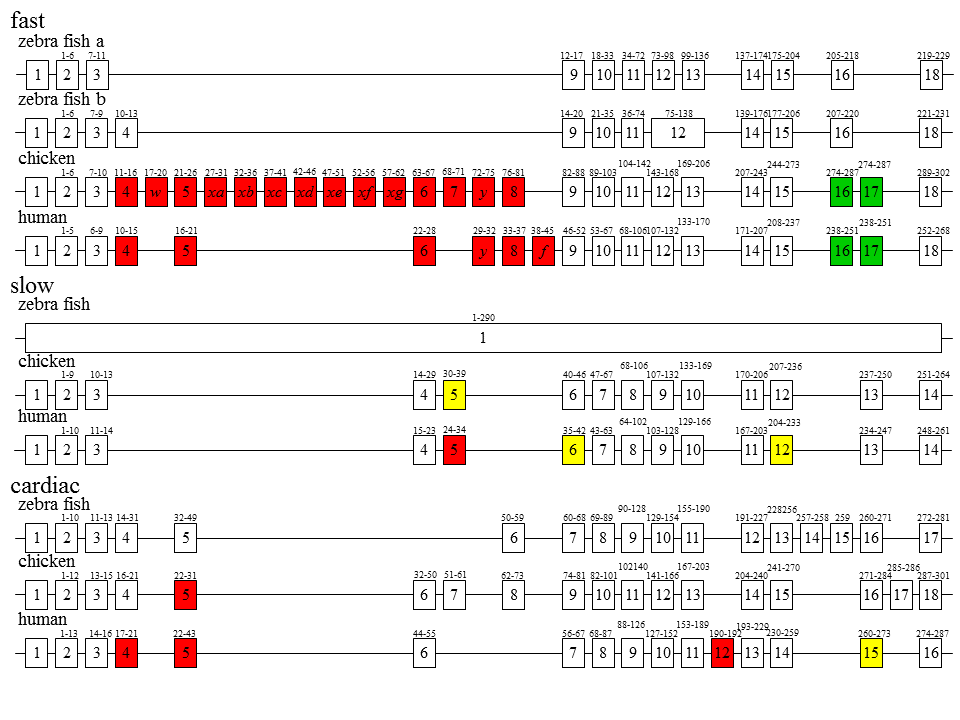
代表的な遺伝子の構造を示す。ニワトリやヒトの速筋型遺伝子では、5‘側にカセット型の選択的スプライシングを受ける部分があり、3’側に相互排他的な選択的スプライシングを受ける部分がある。これらの部分がトロポニンTアイソフォームの多様性を産み出している。これらの部分はトロポニンTの機能とそのようにかかわっているのだろうか?
説明文の3
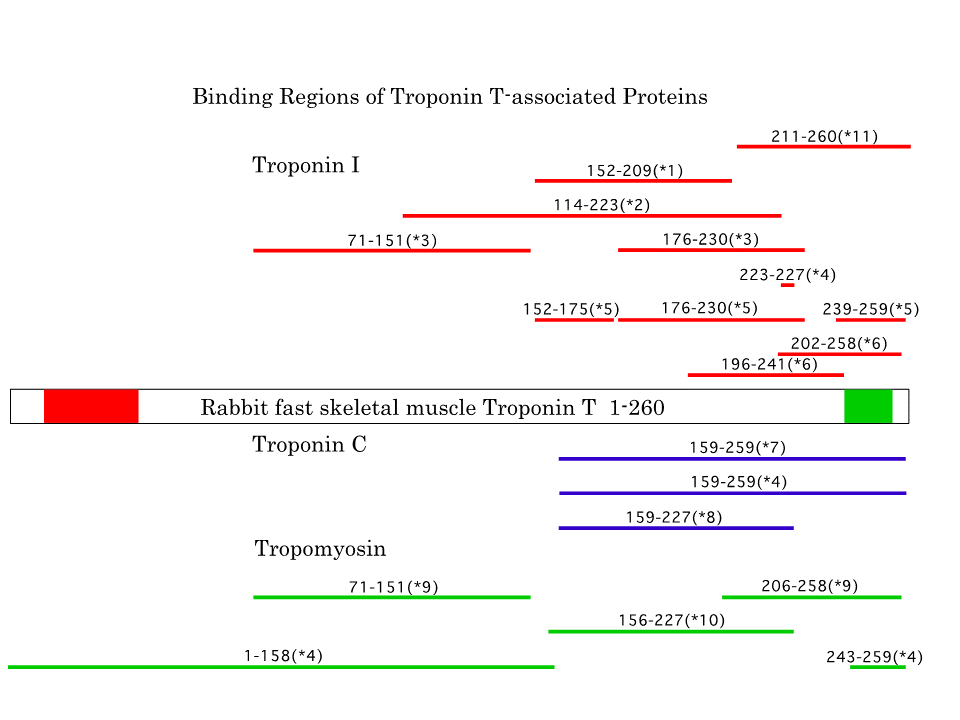
トロポニンTの構造を、よく調べられているウサギの速筋型トロポニンTで示す。トロポニンTは、トロポニンC、トロポニンI、トロポミオシンと結合する。その結合領域を調べた多くの研究があるが、明確に結合領域が決まったとはいえない。 しかし、トロポニンCはC末端側(青色の線で示す)に結合し、トロポニンIも主としてC末端側(赤色の線で示す)に結合することが示されている。一方、トロポミオシンは主として中央部あたりからN末端側(緑色の線で示す)に結合することが示されている。遺伝子の3‘側の相互排他的な選択的スプライシングを受ける部分(緑色の領域)は、トロポニンCとトロポニンI、またおそらくトロポミオシンとの結合に関係すると思われる。しかし、遺伝子の5’側のカセット型選択的スプライシングをうける部分(赤色の領域)と結合することが確実な蛋白質はない。
説明文の4
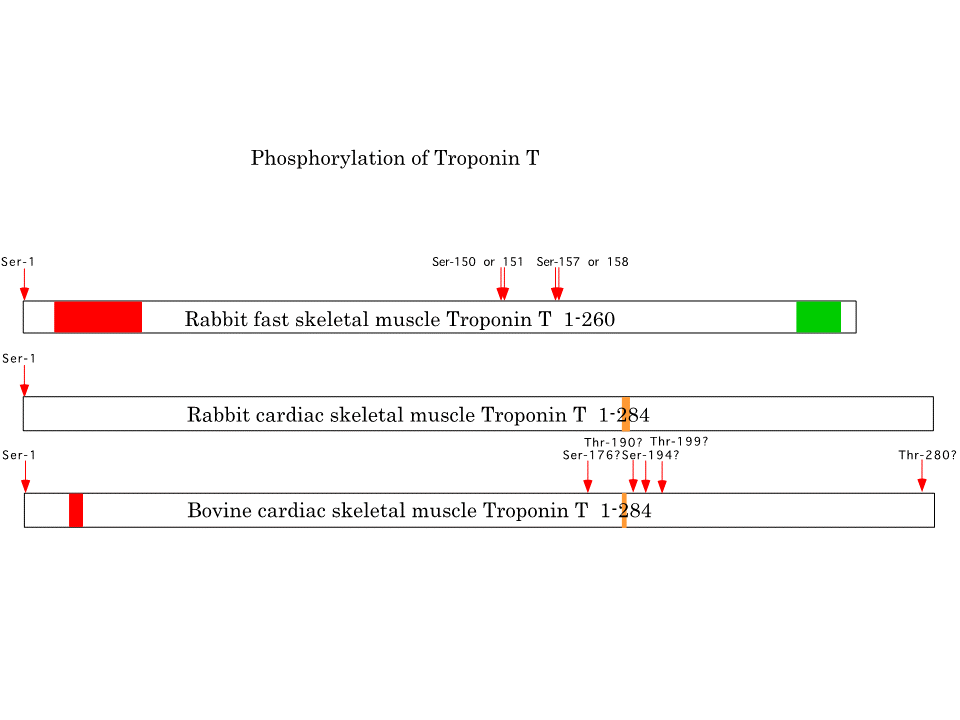
蛋白質の機能に何らかの影響を与えると考えられるリン酸化に係る部位についても、ウサギの速筋型及び心筋型トロポニンTで調べられている。また、ウシの速筋型トロポニンTでも調べられている。リン酸化される部位はN末端と、中央辺りからC末端側であり、ウシの速筋型トロポニンTではC末端近くもリン酸化されるらしい。トロポニンTアイソフォームの多様性に最も貢献する遺伝子の5’側のカセット型選択的スプライシングをうける部分(赤色の領域)は、他の蛋白質との結合にも、リン酸化にもほとんど関係しないようにみえる。
説明文の5
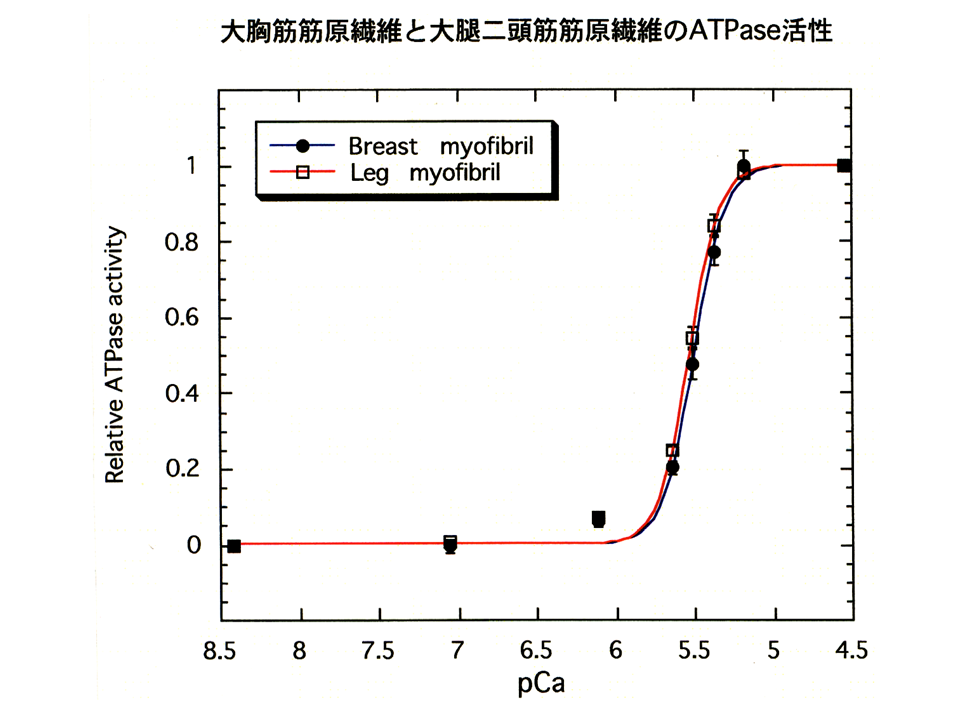
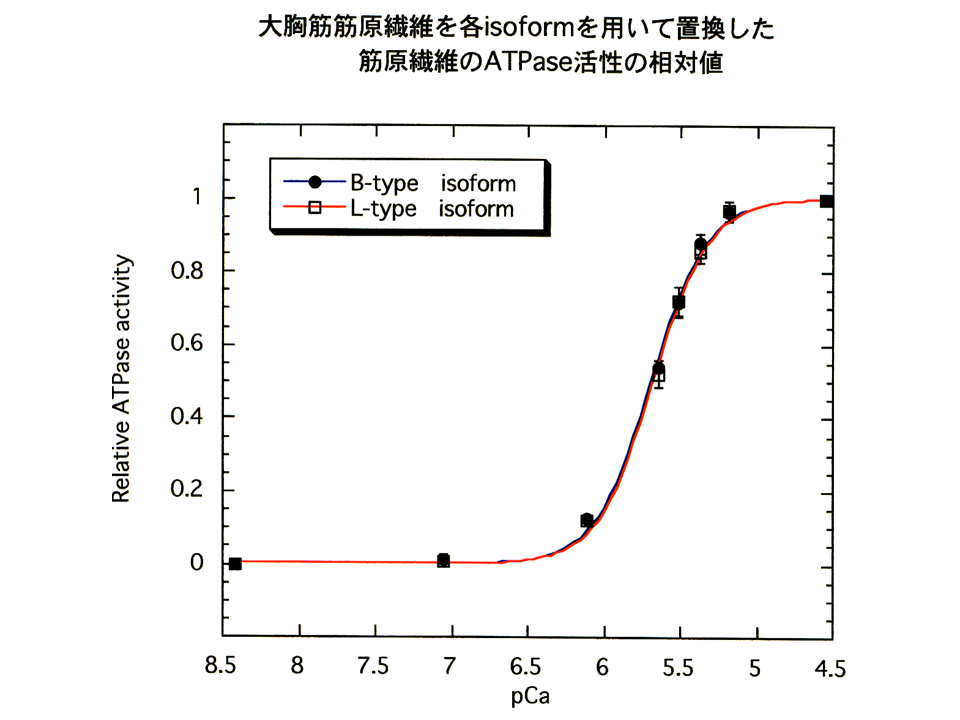
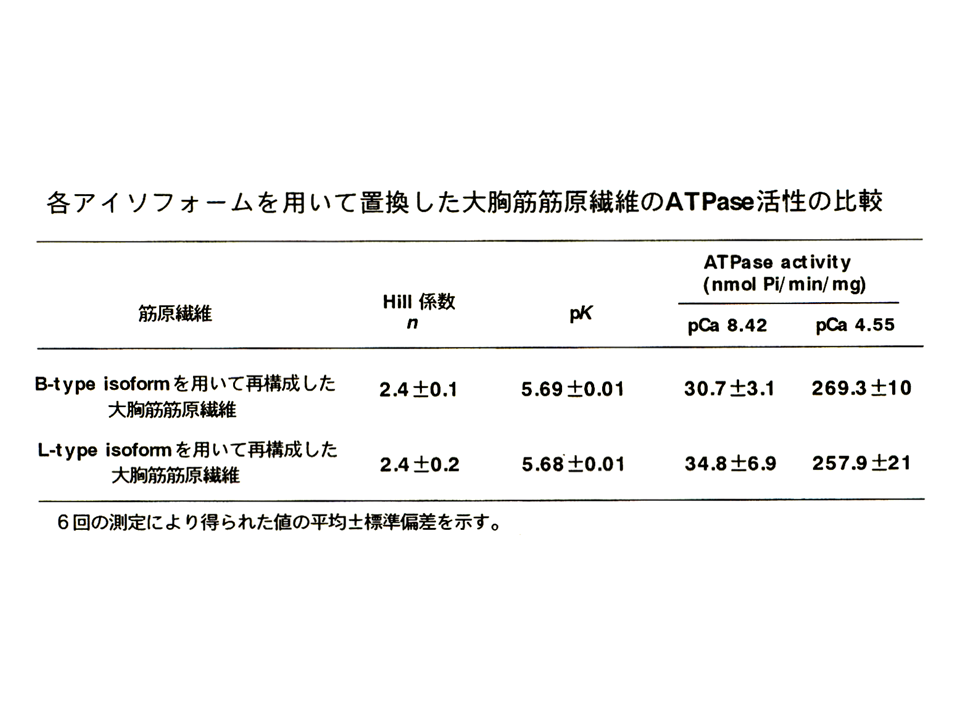
そこでまずニワトリの大胸筋の速筋B型アイソフォームと大腿二頭筋の速筋L型アイソフォームの機能を比べてみることにした。そのためにATPase assayを用いた。筋肉が収縮するときにミオシンによってATPが分解される、その活性を調べる方法である。まず、大胸筋筋原繊維と大腿二頭筋筋原繊維を分離して、ATPase assayを行った。図の縦軸は最大活性値を1とした時の相対的なATPase活性を示し、横軸はカルシウムの濃度を示している。pCaが7の時、カルシウム濃度は10-7mol/lである。筋は細胞内のカルシウム濃度が上昇すると収縮する(ATPが分解される)。すなわちATPase活性が高くなる。大胸筋筋原繊維(黒色の線)と大腿二頭筋筋原繊維(赤色の線)のpCaカーブ(相対的ATPase活性とカルシウムの濃度の関係を示すカーブ)はほぼ重なっており、ほとんど違いがみられなかった。

説明文の6
pCaカーブから、Hill係数とpKが得られる。pKはATPaseの相対活性が半分(0.5)の時のpCaである(カルシウムに対する感受性)。Hill係数は簡単に述べると、pCaカーブの傾き、すなわち蛋白質の反応の共働性を示している。pCaカーブの傾きが大きいと、Hill係数は大きく、共働性も大きくなる。大胸筋筋原繊維と大腿二頭筋筋原繊維の間では、Hill係数とpKのどちらにも差がなかった。
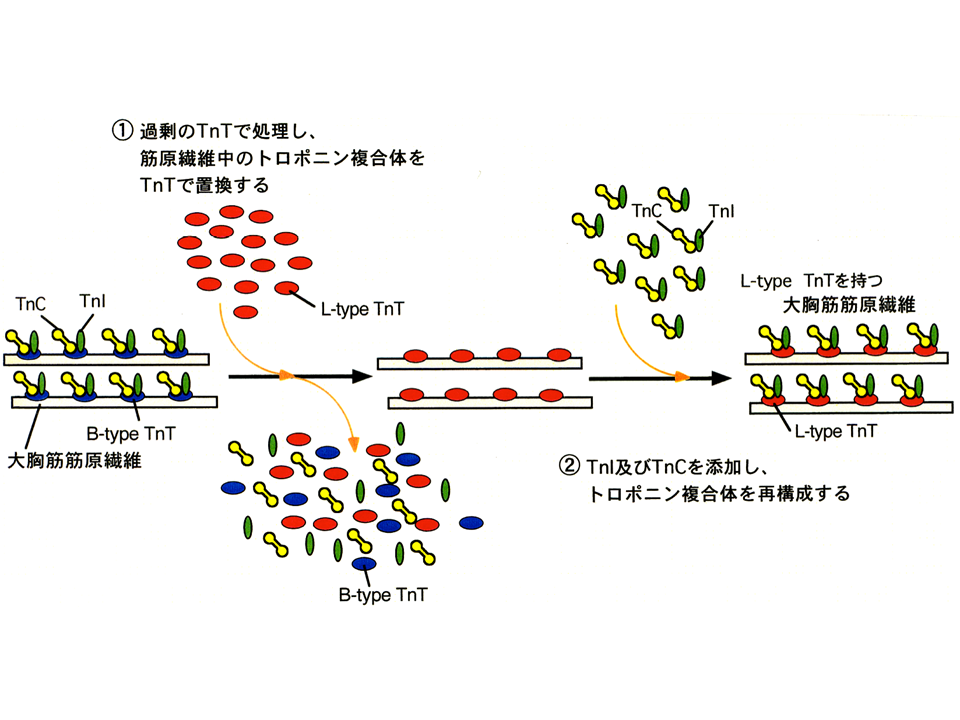
説明文の7
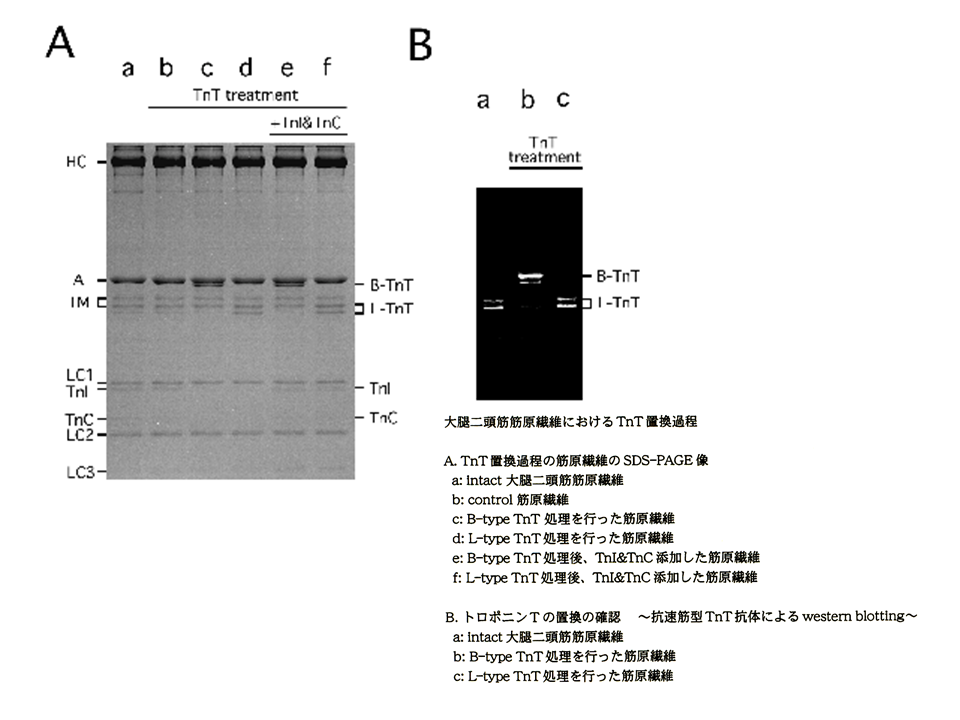
これらの筋原線維のトロポニンTを目的にあったアイソフォームに置き換える。まず、トロポニンTの大胸筋の速筋B型アイソフォームと大腿二頭筋の速筋L型アイソフォームを精製した。また、速筋型トロポニンCとトロポニンIも精製した。大胸筋筋原繊維をある条件において、もともとあった大胸筋筋原繊維のトロポニンTB型アイソフォーム、トロポニンC、トロポニンIを引きはがした。その後多量のトロポニンTL型アイソフォームを加えて結合させた。次にトロポニンCとトロポニンIを加えて、大胸筋筋原繊維にトロポニンTL型アイソフォームを含むトロポニン複合体を再構築した。
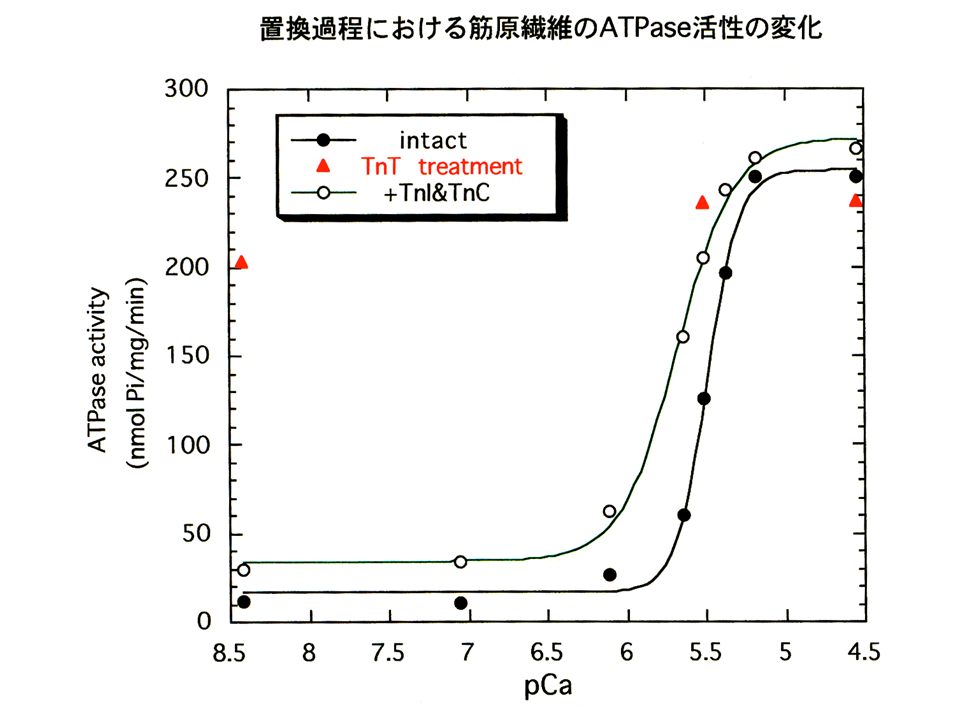
説明文の8
トロポニン複合体を再構築した場合(白色の丸で示す)は、何もしなかった場合(黒色の丸で示す)に比べ、Hill係数が小さくなった。トロポニンCとトロポニンIを加えなかった場合(赤色の三角で示す)は、収縮を調節できなくなるので、カルシウム濃度に関係なくATPase活性が高かった。縦軸は相対値ではなく、ATPase活性そのものである。
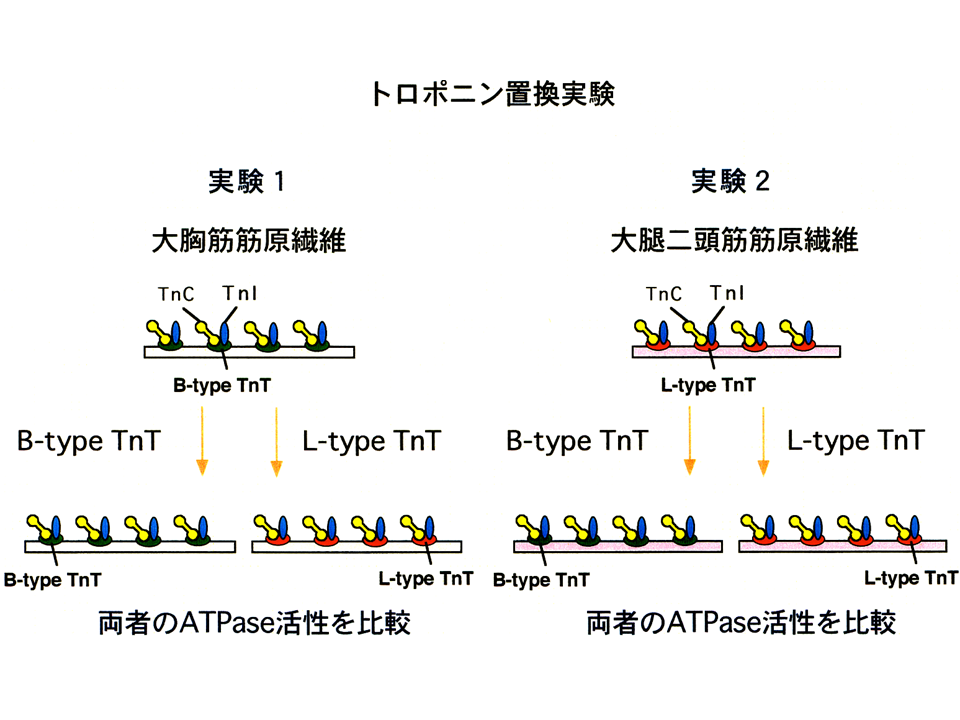
説明文の9
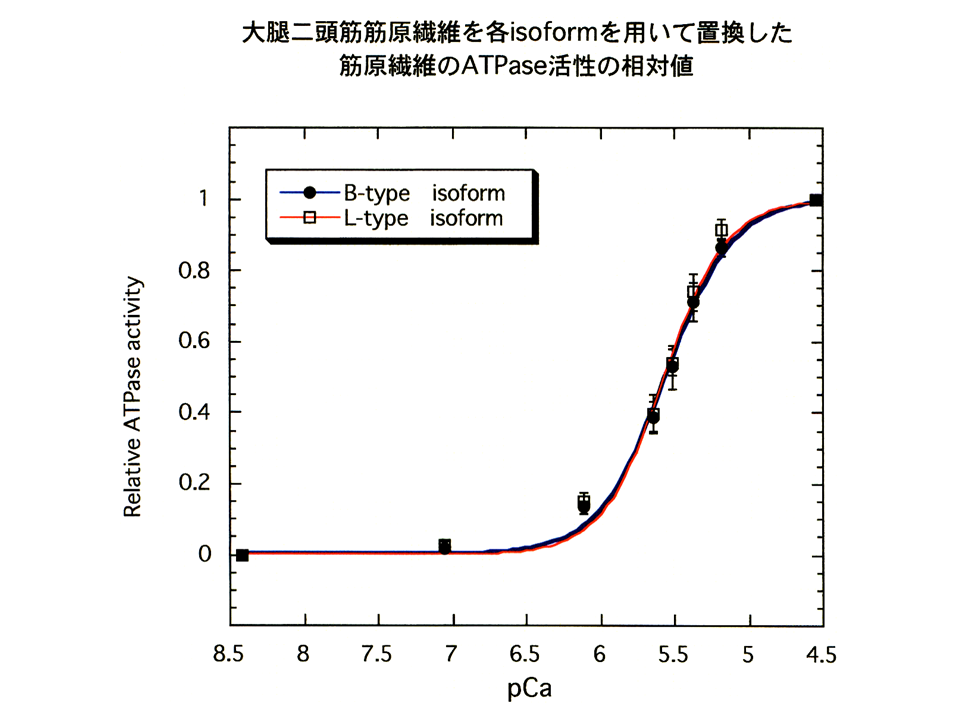
大胸筋筋原繊維にトロポニンTB型アイソフォームを含むトロポニン複合体とトロポニンTL型アイソフォームを含むトロポニン複合体を再構築した。また、大腿二頭筋筋原繊維にトロポニンTL型アイソフォームを含むトロポニン複合体とトロポニンTB型アイソフォームを含むトロポニン複合体を再構築した。すなわち、トロポニン複合体を再構築した4種類に筋原繊維を作製し、ATPase assayを行った。
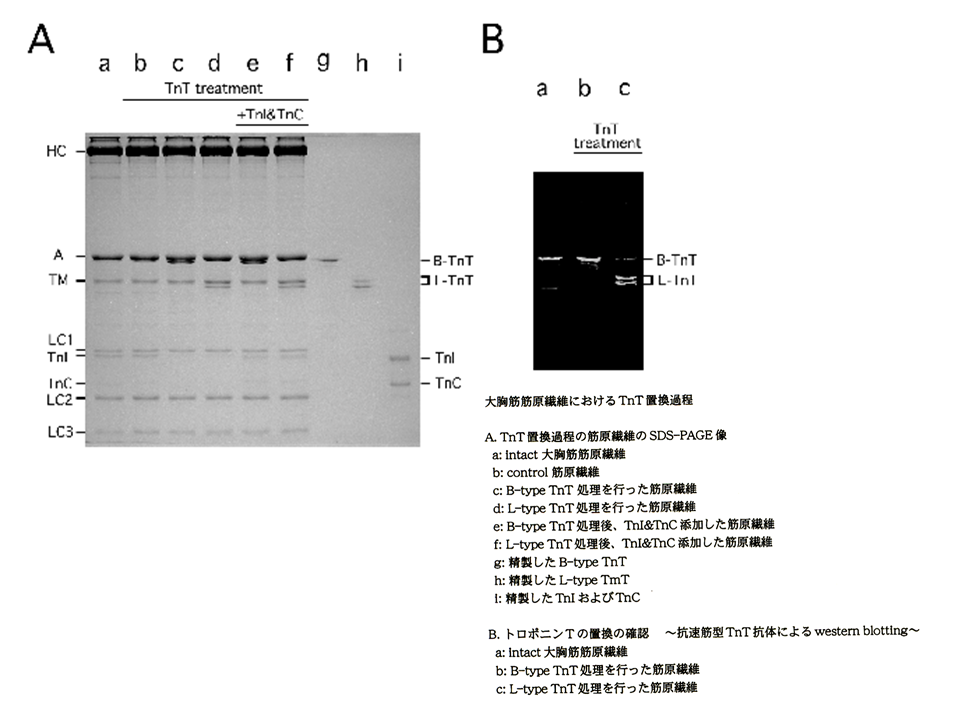
説明文の10
A:何もしていない大胸筋筋原繊維では、トロポニンTB型アイソフォーム(アクチンと重なってしまって明確には見えない)、トロポニンC、トロポニンIがみられた(a)。トロポニンの再構築を行う前の筋原繊維(b)。トロポニンT、トロポニンC、トロポニンIをはがした後、トロポニンTB型アイソフォームを結合させた筋原繊維(c)とトロポニンTL型アイソフォームを結合させた筋原繊維(d)。これらの筋原繊維には、トロポニンC、トロポニンIがみられなかった。トロポニンC、トロポニンIを加えて、トロポニン複合体を再構築した筋原繊維(e、f)。再びトロポニンC、トロポニンIがみられるようになった。B:速筋型トロポニンTに対する抗体でトロポニンTを検出した場合、もともとの大胸筋筋原繊維では、分子量の大きいB型アイソフォームがみられた(a)。トロポニンTB型アイソフォームで入れ替えた大胸筋筋原繊維では、B型アイソフォームがみられたが(b)、トロポニンTL型アイソフォームで入れ替えた大胸筋筋原繊維では、分子量の小さいL型アイソフォームがみられた(c).
説明文の11
トロポニンTB型アイソフォームを含むトロポニン複合体を再構築した大胸筋筋原繊維(黒色の線)とトロポニンTL型アイソフォームを含むトロポニン複合体を再構築した大胸筋筋原繊維(赤色の線)を比較すると、pCaカーブはほぼ重なった。
説明文の12
Hill係数、pKには統計学的に有意な差が無かった。ATPaseの活性(最大、最小)にもほとんど差が無かった。
説明文の13
A:何もしていない大腿二頭筋筋原繊維では、トロポニンTL型アイソフォーム、トロポニンC、トロポニンIがみられた(a)。トロポニンの再構築を行う前の筋原繊維(b)。トロポニンT、トロポニンC、トロポニンIをはがした後、トロポニンTB型アイソフォームを結合させた筋原繊維(c)とトロポニンTL型アイソフォームを結合させた筋原繊維(d)。これらの筋原繊維には、トロポニンC、トロポニンIがみられなかった。トロポニンC、トロポニンIを加えて、トロポニン複合体を再構築した筋原繊維(e、f)。再びトロポニンC、トロポニンIがみられるようになった。B:速筋型トロポニンTに対する抗体でトロポニンTを検出した場合、もともとの大腿二頭筋筋原繊維では、分子量の小さいL型アイソフォームがみられた(a)。トロポニンTB型アイソフォームで入れ替えた大腿二頭筋筋原繊維では、分子量の大きいB型アイソフォームがみられたが(b)、トロポニンTL型アイソフォームで入れ替えた大腿二頭筋筋原繊維では、L型アイソフォームがみられた(c).
説明文の14
トロポニンTB型アイソフォームを含むトロポニン複合体を再構築した大腿二頭筋筋原繊維(黒色の線)とトロポニンTL型アイソフォームを含むトロポニン複合体を再構築した大腿二頭筋筋原繊維(赤色の線)を比較すると、pCaカーブはほぼ重なった。
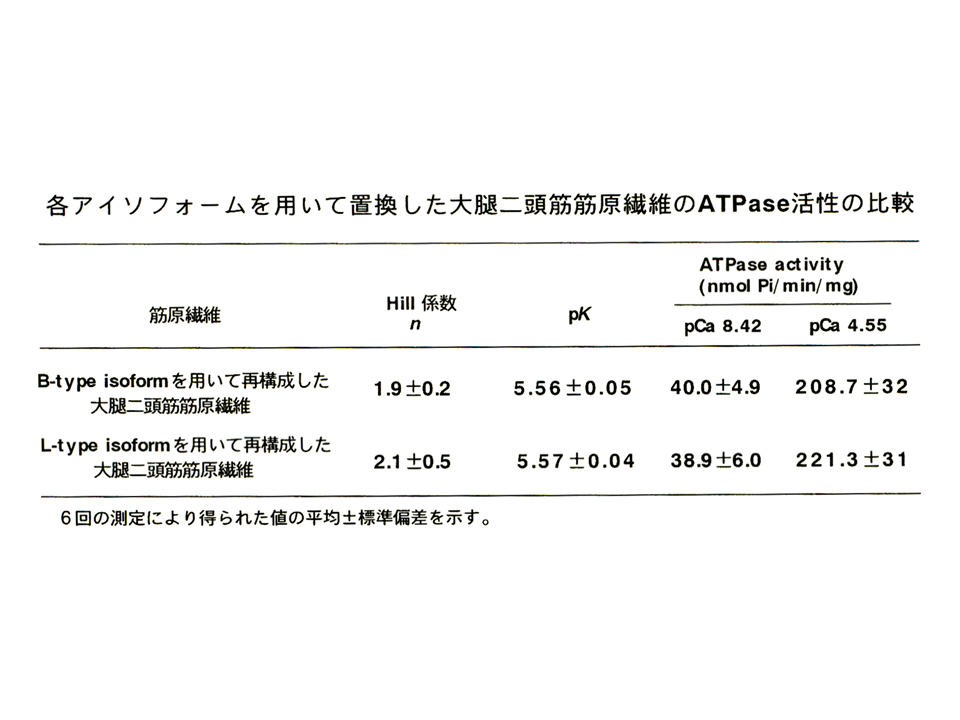
説明文の15
Hill係数、pKには統計学的に有意な差が無かった。ATPaseの活性(最大、最小)にもほとんど差が無かった。
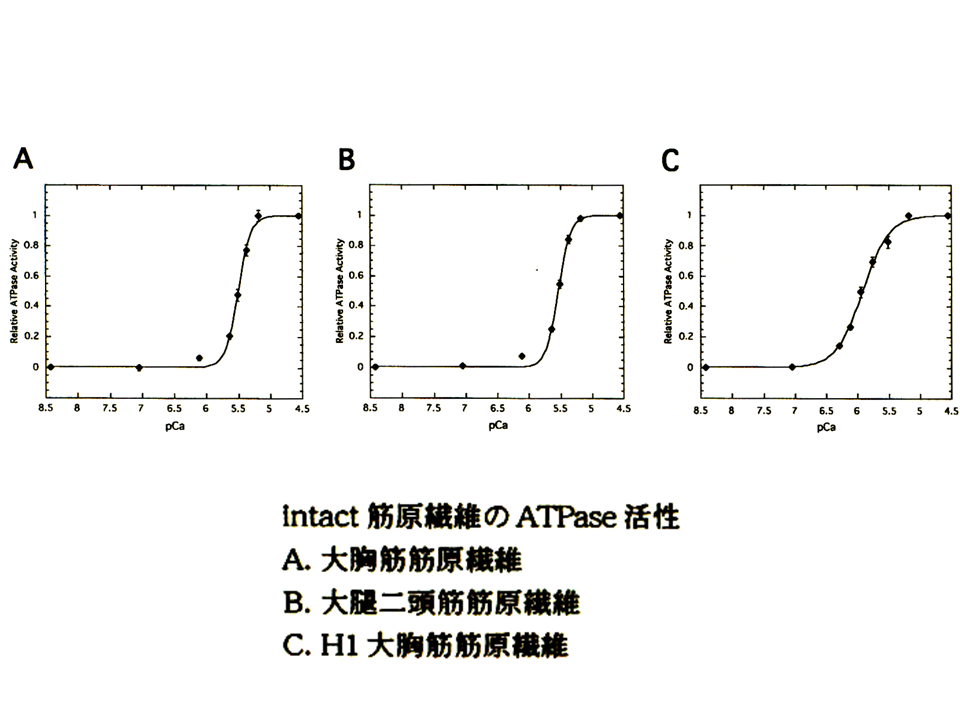
説明文の16
大人の筋原繊維を用いた場合には、トロポニンTB型アイソフォームとL型アイソフォームとの間には機能の差がみられなかった。そこで、孵化後1日目ヒヨコの大胸筋筋原繊維を用いた。大人の筋原繊維とヒヨコの筋原繊維のpCaカーブは異なった。
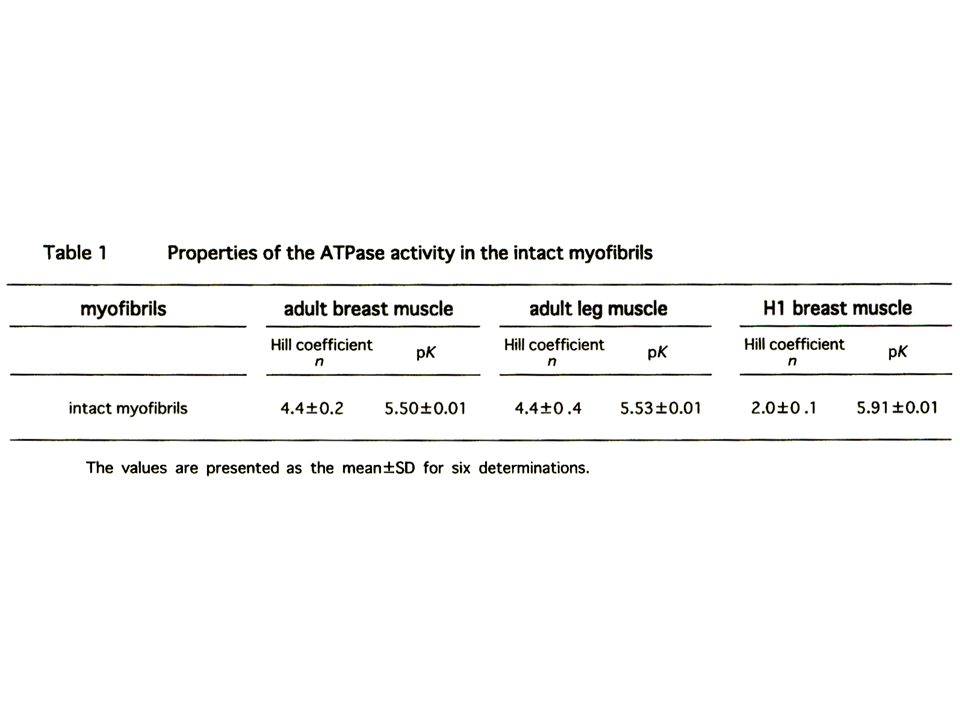
説明文の17
ヒヨコの筋原繊維では、大人の筋原繊維に比べてHill係数が著しく小さくなった。pKには大きな差がなかった。
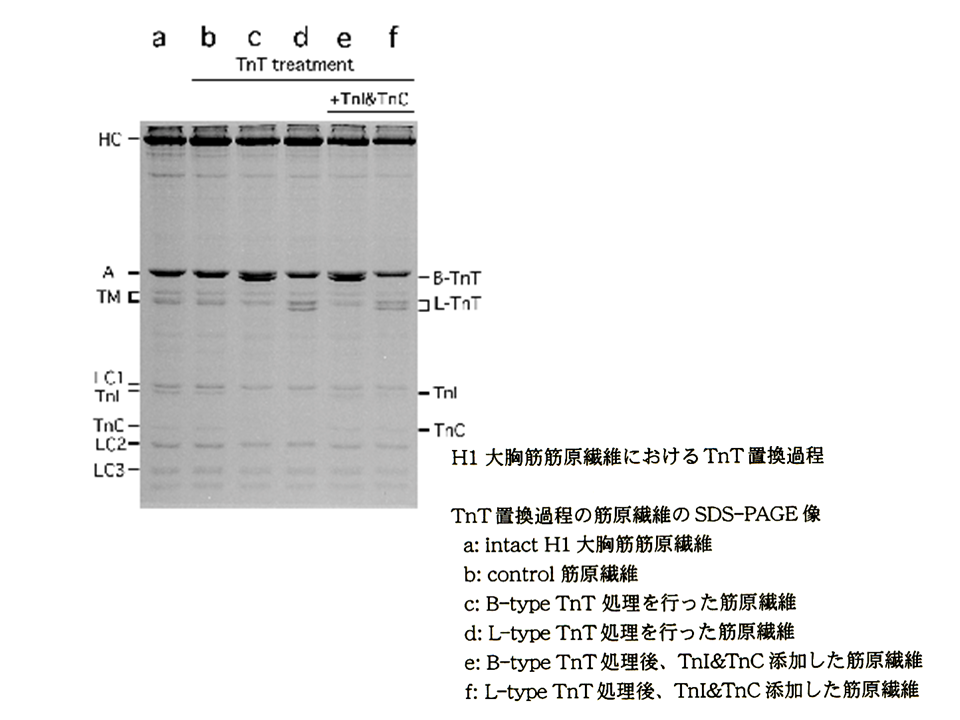
説明文の18
何もしていない孵化後1日目ヒヨコの大胸筋筋原繊維では、トロポニンTL型アイソフォーム、トロポニンC、トロポニンIがみられた(a)。トロポニンの再構築を行う前の筋原繊維(b)。トロポニンT、トロポニンC、トロポニンIをはがした後、トロポニンTB型アイソフォームを結合させた筋原繊維(c)とトロポニンTL型アイソフォームを結合させた筋原繊維(d)。これらの筋原繊維には、トロポニンC、トロポニンIがみられなかった。トロポニンC、トロポニンIを加えて、トロポニン複合体を再構築した筋原繊維(e、f)。再びトロポニンC、トロポニンIがみられるようになった。
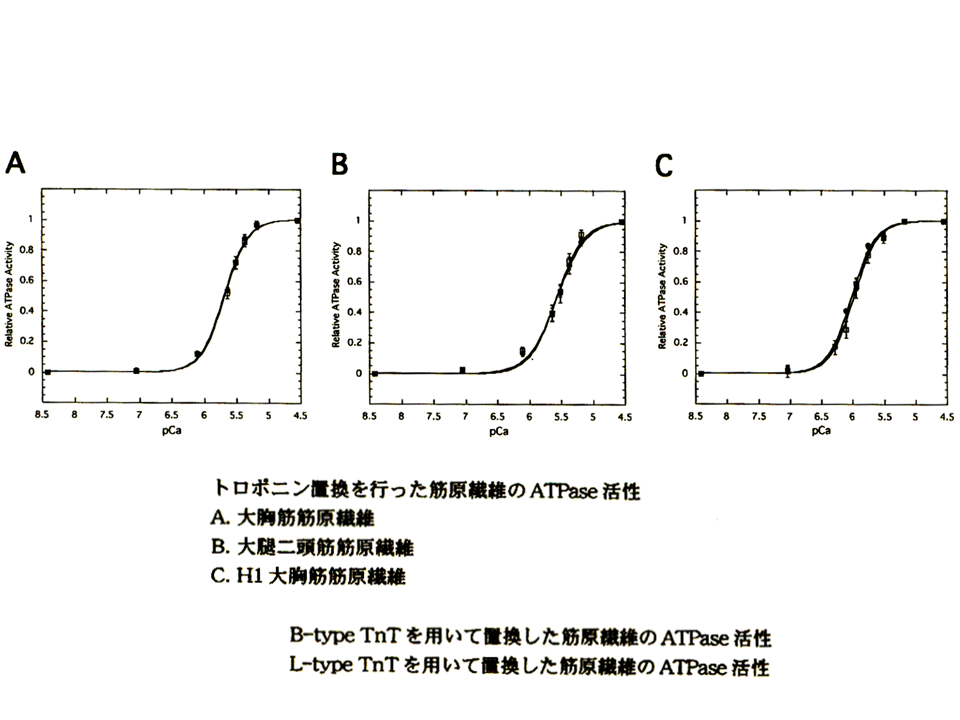
説明文の19
大人の大胸筋筋原繊維、大人の大腿二頭筋筋原繊維、孵化後1日目のヒヨコの筋原繊維において、トロポニンTを入れ換えても、pCaカーブはほぼ重なった。
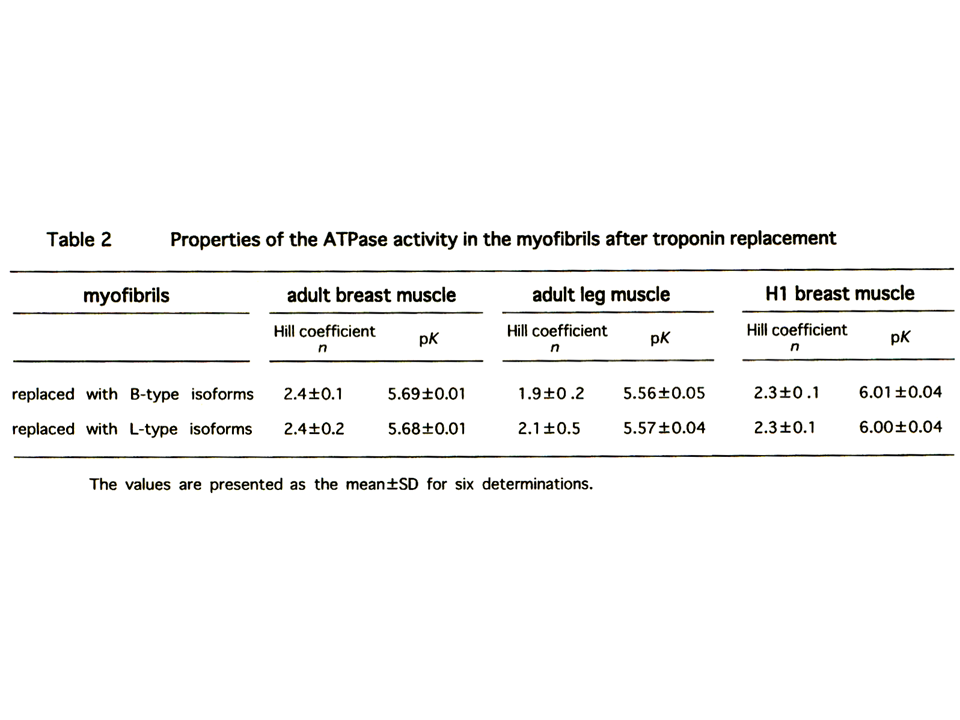
説明文の20
ヒヨコの大胸筋筋原繊維を用いてトロポニンTを入れ換えても、Hill係数、pKには統計学的に有意な差が無かった。

説明文の21
上記のようにトロポニンTB型アイソフォームとL型アイソフォームの間には機能の差がみられなかった。ただし、B型もL型も腹数のアイソフォームを含んでいるので、もし個々のアイソフォームに機能の差があっても、複数のアイソフォームの平均を比べたにすぎず、そのために差がみられなかっただけかもしれない。それゆえ、個々のアイソフォームを比べることにした。しかし、個々のアイソフォームを単独に筋肉から精製するのは不可能なので、mRNAより得たcDNAを含むベクターを大腸菌内で発現させることによって、個々のアイソフォームを得ることにした。用いたmRNAはTnT-3、TnT-4、TnT4Mの3種類であり、TnT-3と他の2つは5‘側のカセット型の選択的エクソンに由来する塩基配列が異なる。TnT-4とTnT4Mは3’側の相互排他的な選択的エクソンに由来する配列が異なる。これらを比べることによって、5‘側のカセット型の選択的エクソンに基づく機能的な相違と3’側の相互排他的な選択的エクソンに基づく機能的な相違を明らかにできると思われる。
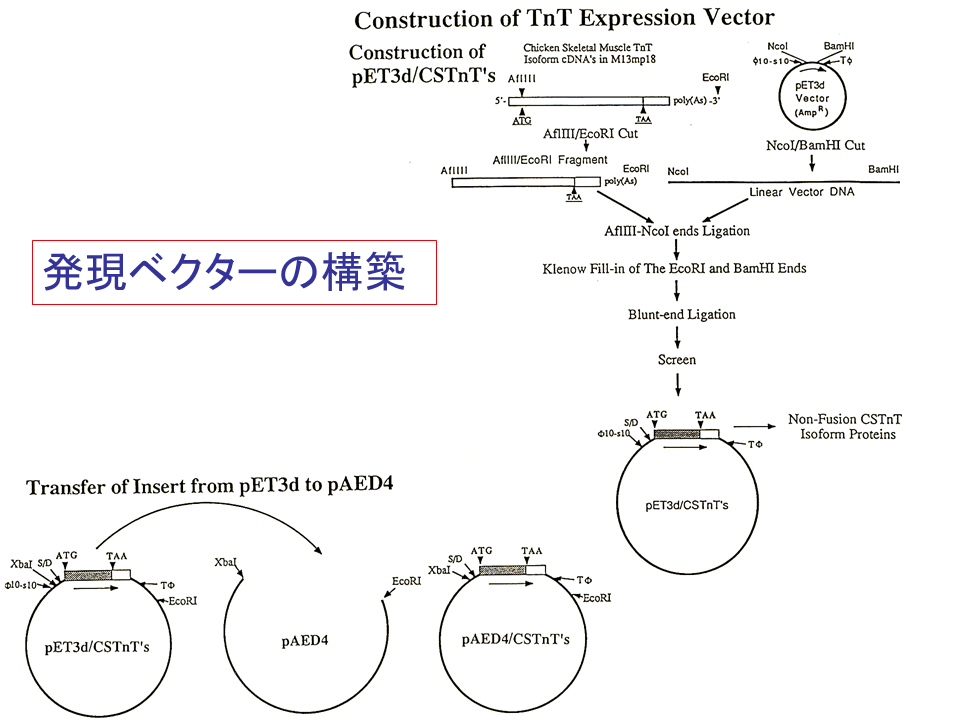
説明文の22
TnT-3、TnT-4、TnT4MのcDNAを各々pET3dベクターに挿入したが、大腸菌でうまく働かなかったので、挿入部をpAED4ベクターに移した。

説明文の23
cDNAを含むpAED4ベクターを用いて、大腸菌内でTnT-3、TnT-4、TnT4M蛋白質の合成を行った。その発現は大腸菌内のpLysSプラスミッドによって調節されている。pLysSプラスミッドによって、大腸菌内でT7 Lysozymeが合成される。T7 LysozymeはpAED4ベクターを発現させるT7 polymeraseの活性を抑制している。しかし、IPTGを加えるとT7 polymeraseが活性化され、pAED4ベクターが機能するようになる。したがって、IPTGを加えることによってTnT-3、TnT-4、TnT4M蛋白質の合成が始まる。
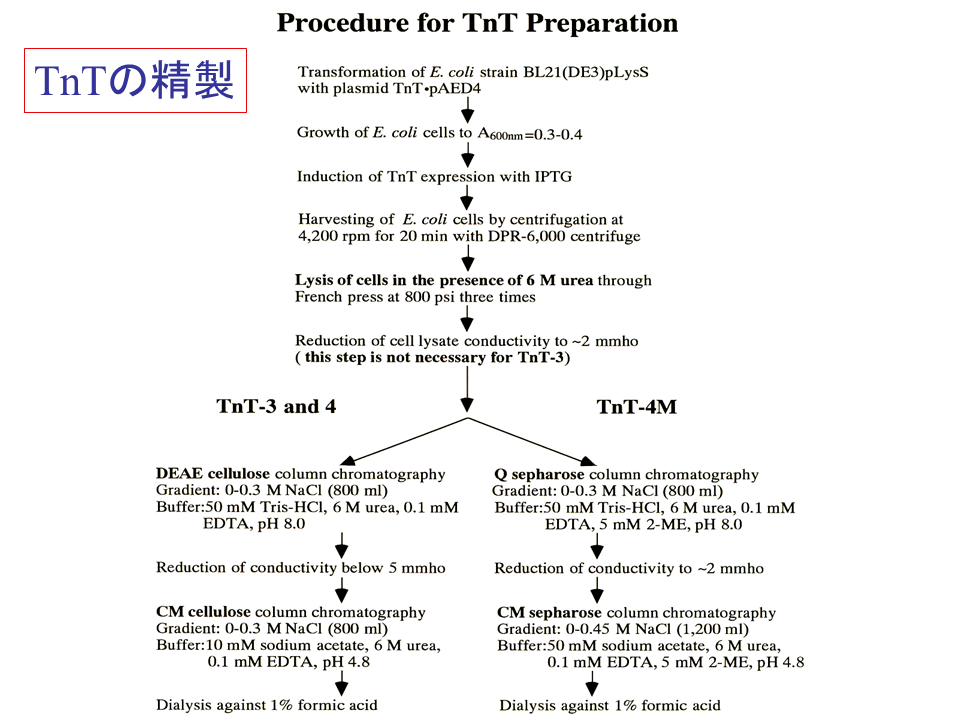
説明文の24
大腸菌より合成されたTnT-3、TnT-4、TnT4M蛋白質を精製した。これが困難を極めた。TnT-3のTnT“trouble” 、TnT-4はTnT”tough”のT、TnT4MはTnT“terrible”のTと呼んだ。最終的に6 M尿素の存在下で大腸菌を溶菌し、TnT-3及びTnT-4とTnT4Mでは別のカラムクロマトグラフィーを行って精製した。
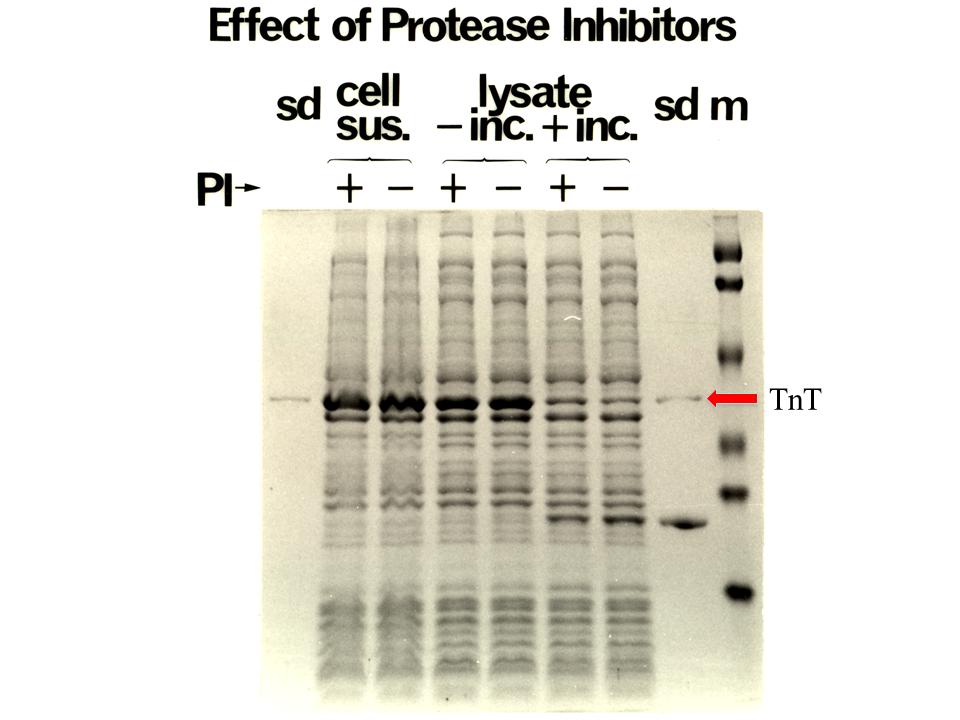
説明文の25
精製が困難であったのは、主に蛋白質分解酵素によって合成したTnT蛋白質が分解酵素によって壊されてしまうためであった。大腸菌懸濁液(cell sus.)あるいはインキュベーションしない溶菌液(lysate -inc)では、TnT蛋白質はあまり分解していないが、インキュベーションした溶菌液(lysate +inc)では、様々な蛋白質分解酵素抑制剤(PI)が存在してもしなくても、TnT蛋白質は分解されてしまった。そこで、6 M尿素の存在下で大腸菌を溶菌し、蛋白質分解酵素の活性を抑えることにした。しかし、6 Mの尿素の存在は次のATPase assayを困難にした。
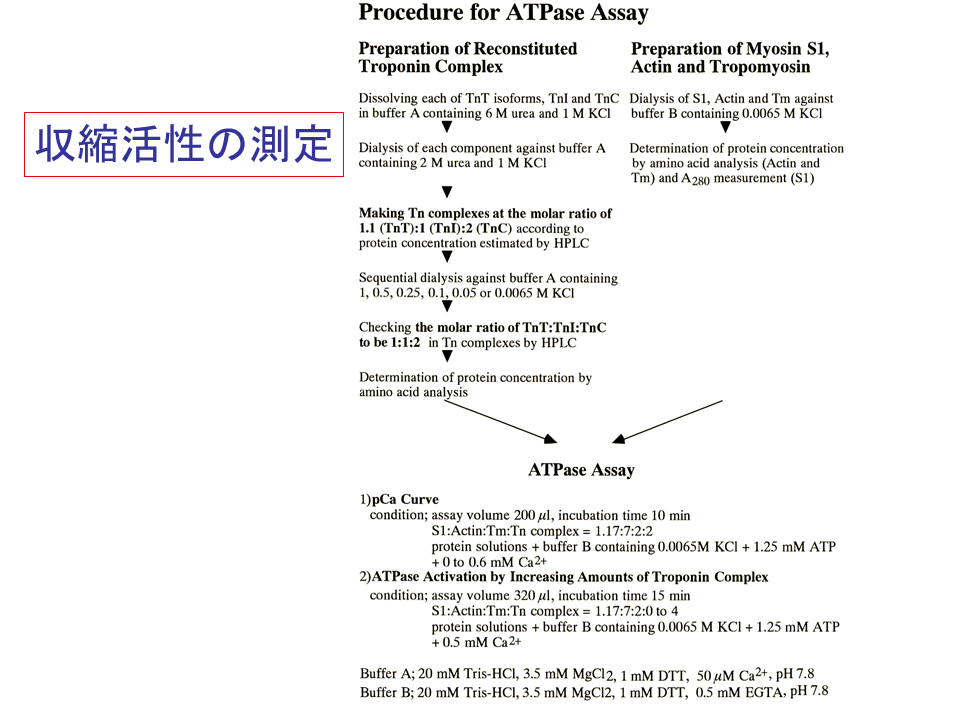
説明文の26
ATPase assayを行うためには、ミオシン、アクチン、トロポミオシン、TnT、TnI、TnCの6種類の蛋白質を準備しなければならないが、ミオシンとアクチンは冷凍保存ができないので、実験ごとに精製しなければならない。特にミオシンの精製は厄介なので、冷凍保存できるミオシンの頭部領域のS1を用いることにした。S1は溶液の塩濃度が高いと働かないので、TnT溶液の尿素をKClに置き換え、さらに0.0065M の濃度まで落とさなければならなかった。急激に濃度を落とすとTnTが沈殿してしまうので、徐々に濃度を落とさなければならなかった。
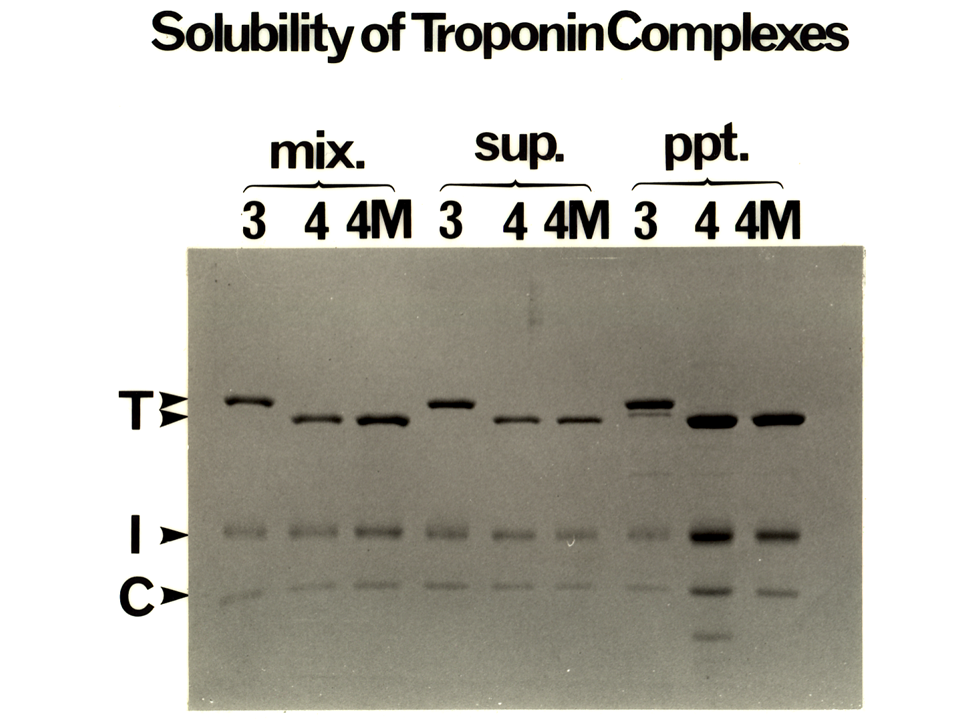
説明文の27
そのようにしてもいくらかのTnTは沈殿してしまった。2 M尿素・1 MKClでトロポニン複合体を形成させ、その後1 MKClから0,0065 MKClまで徐々に濃度を下げると、トロポニン複合体は沈殿するものもあったが(ppt.)、溶液中にも生き残った(sup.)。トロポニン複合体を形成させた際、TnT1.1に対して、TnIは1、TnCは2を混合した。
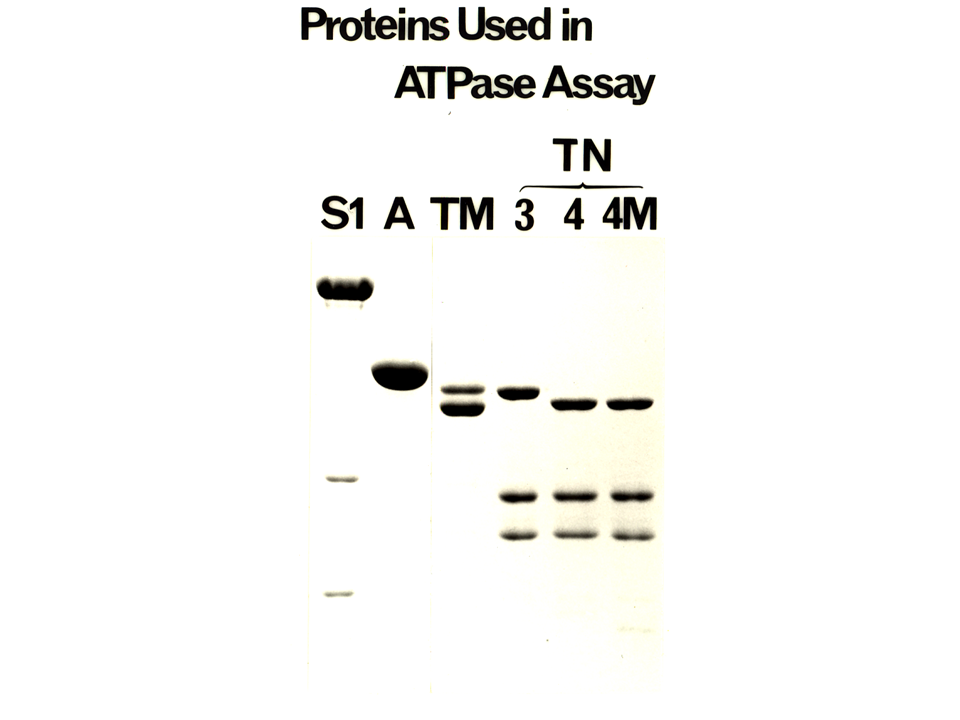
説明文の28
ATPase assayに用いた蛋白質である。ミオシンS1、アクチン、トロポミオシン、トロポニン複合体(TnT3+TnI+TnC、TnT4+TnI+TnC、TnT4M+TnI+TnC)。TnTとアクチンは同時進行で実験ごとに精製した。
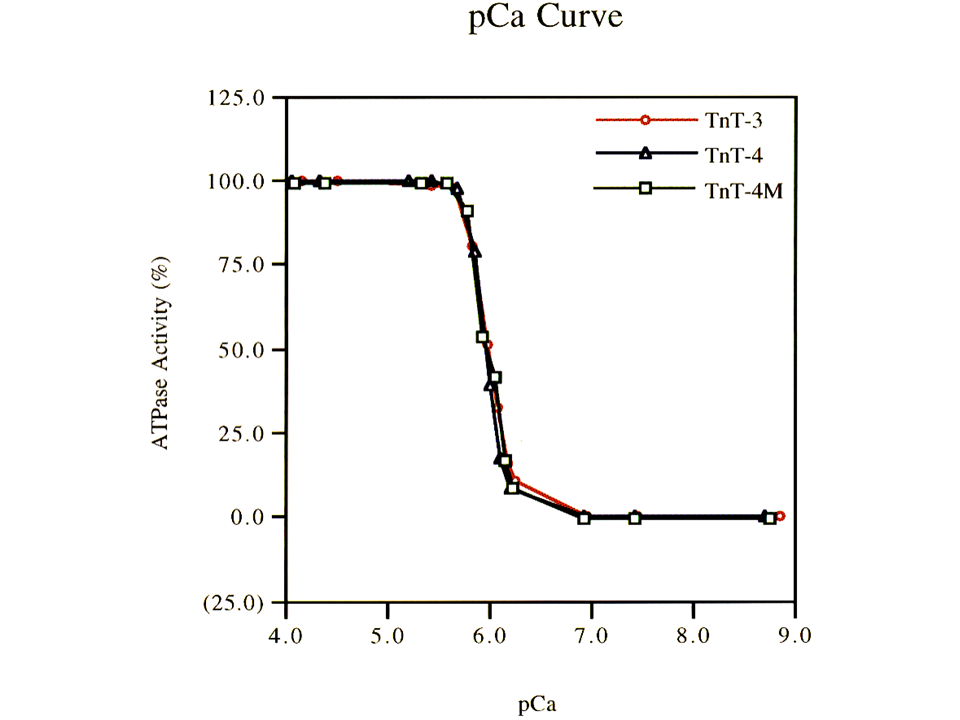
説明文の29
TnT-3(赤色の線)、TnT-4(青色の線)、TnT4M(黒色の線)を各々用いて行ったATPase assayの結果である。pCaカーブの横軸では左の方がカルシウム濃度が高く、右の方が低い。上述のpCaカーブの横軸では右の方がカルシウム濃度が高く、左の方が低かったので注意。なんと、3つのpCaカーブはほとんど重なっているようにみえる!
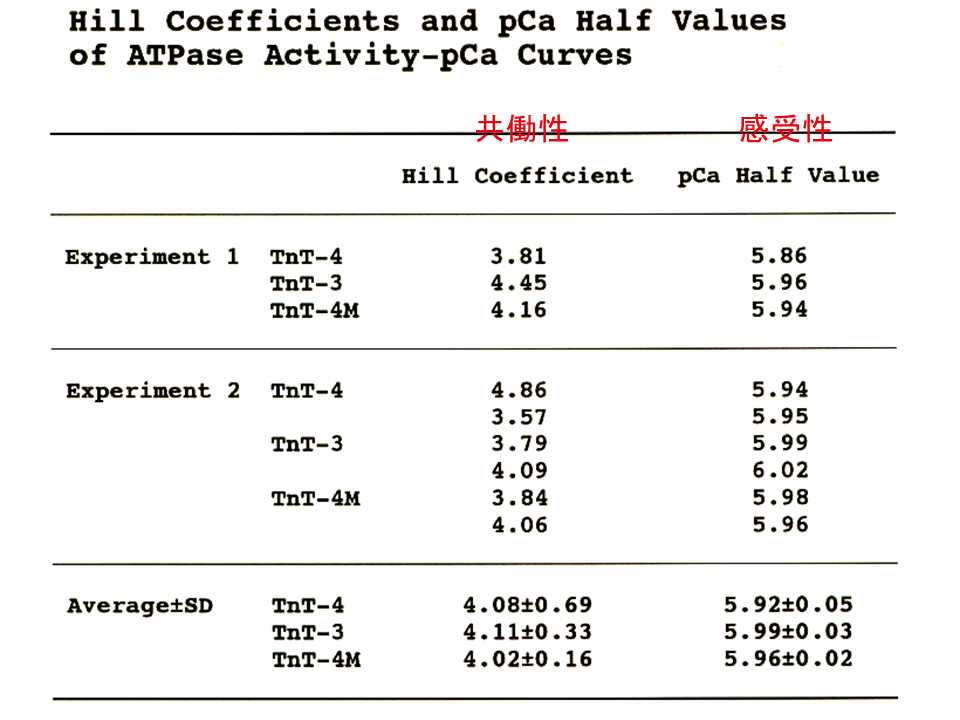
説明文の30
3回の実験を行った平均をみてみると、Hill係数(共働性)とpCa Half(上述ではpK感受性)の間に統計学的な差がみられないことがわかる。
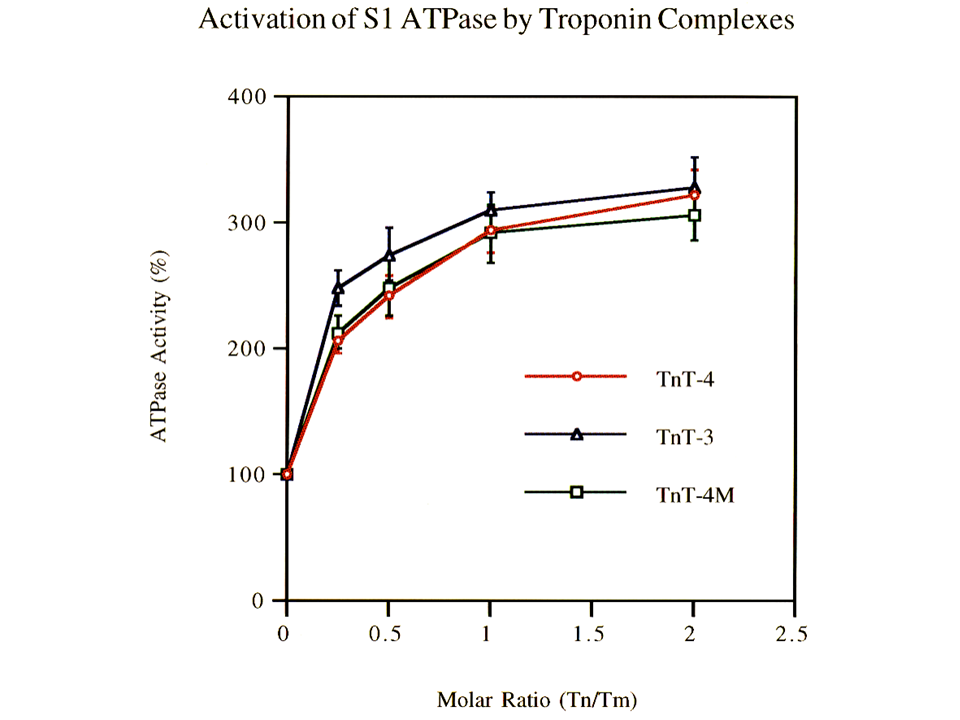
説明文の31
このようにTnT-3、TnT-4、TnT4Mの間には差がみられなかったが、トロポニン複合体とトロポミオシンの比をかえてみた。筋肉では、トロポニン複合体とトロポミオシンは、1対1の比で機能するとされているが、トロポニン複合体に対するトロポミオシンンの比が、0.25、0.5、1の際にATPase化活性に差がみられた。縦軸は相対値ではなく、ATPase活性そのものである。
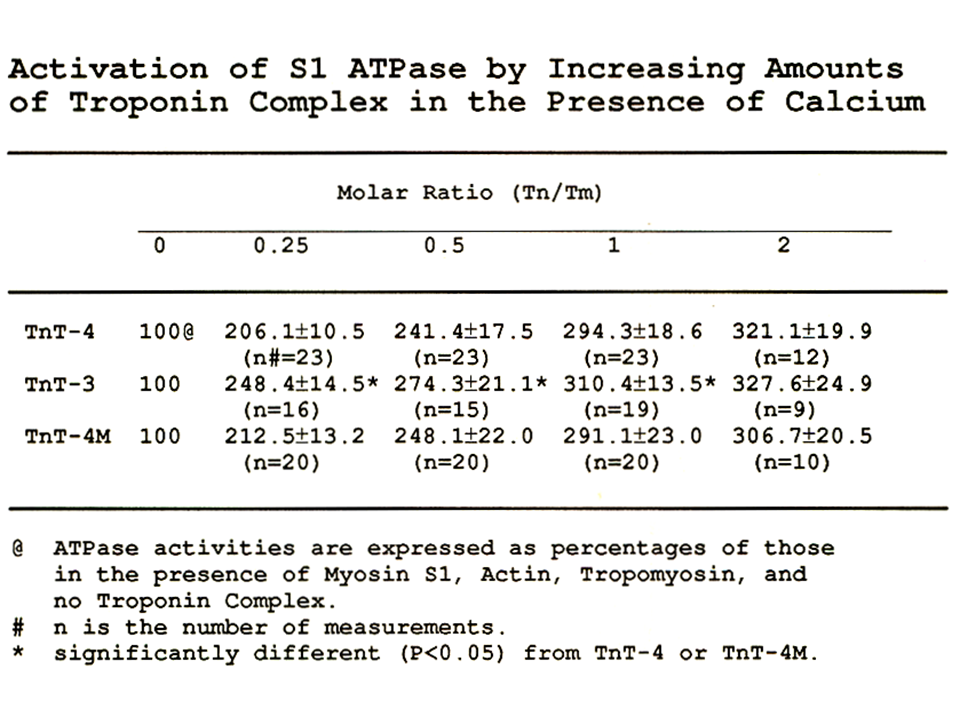
説明文の32
トロポニン複合体に対するトロポミオシンンの比が、0.25、0.5、1の際にTnT3だけATPase活性が高かった。すなわち、筋が未成熟な時(トロポニン複合体に対するトロポミオシンンの比が安定しない時)、TnT-3はATPase活性を高めるために有効に機能すると思われた。
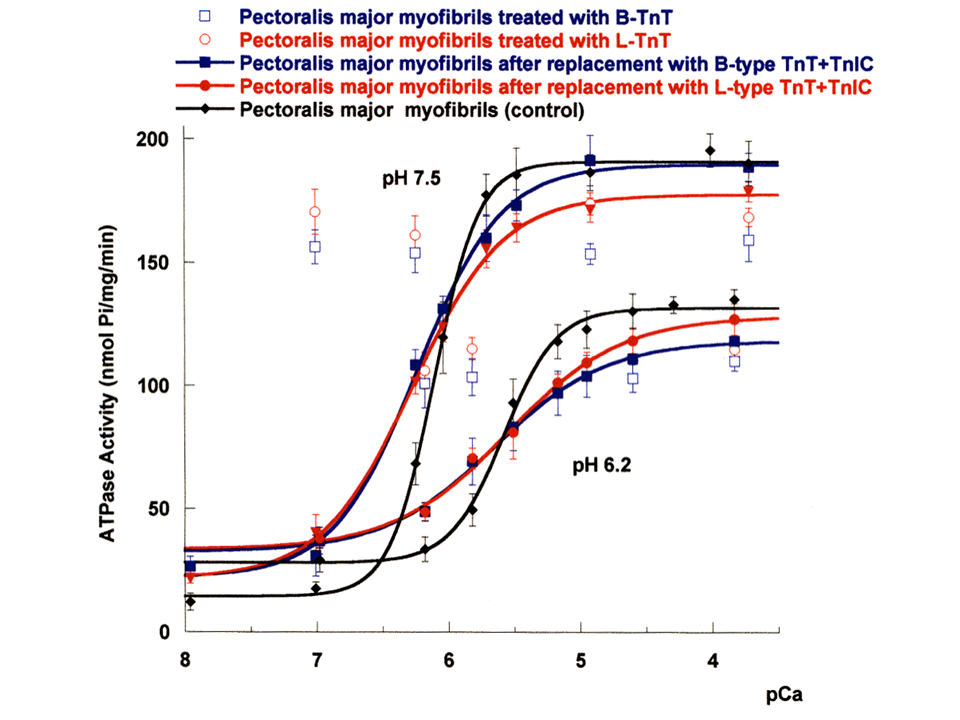
説明文の33
また、B型とL型アイソフォームの比較に戻ろう。大胸筋筋原繊維のATPase活性をpHを変えて測定してみた。もともとの筋原繊維(黒色丸、黒色線で示す)、並びにB型アイソフォームを含むトロポニン複合体(黒色四角、黒色線で示す)とL型アイソフォームを含むトロポニン複合体(赤色丸、赤色線で示す)で各々置換した筋源繊維では、pH7.5の方がpH6.2よりATPase活性が高くなった。B型(青色四角で示す)とL型(赤色丸で示す)アイソフォームで各々置換して、トロポニンIとCを加えなった場合は、筋肉の収縮・弛緩の調節ができなくなるので、カルシウム濃度に関係なくATPase活性は高くなった。縦軸は相対値ではなく、ATPase活性そのものである。
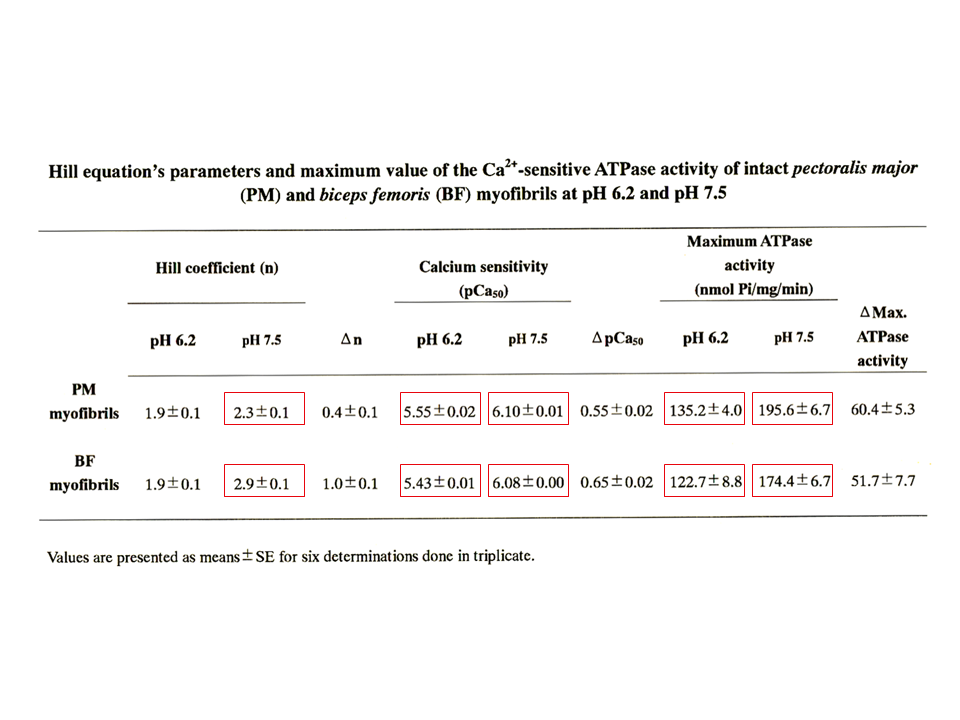
説明文の34
大胸筋筋原繊維と大腿二頭筋筋原繊維で、pHを変えてATPase活性を測定した場合、pH7.5でHill係数に、どちらのpHでもpCa50(上述ではpK)に、また、どちらのpHでもATPase活性に、両筋原繊維の間で差がみられた。
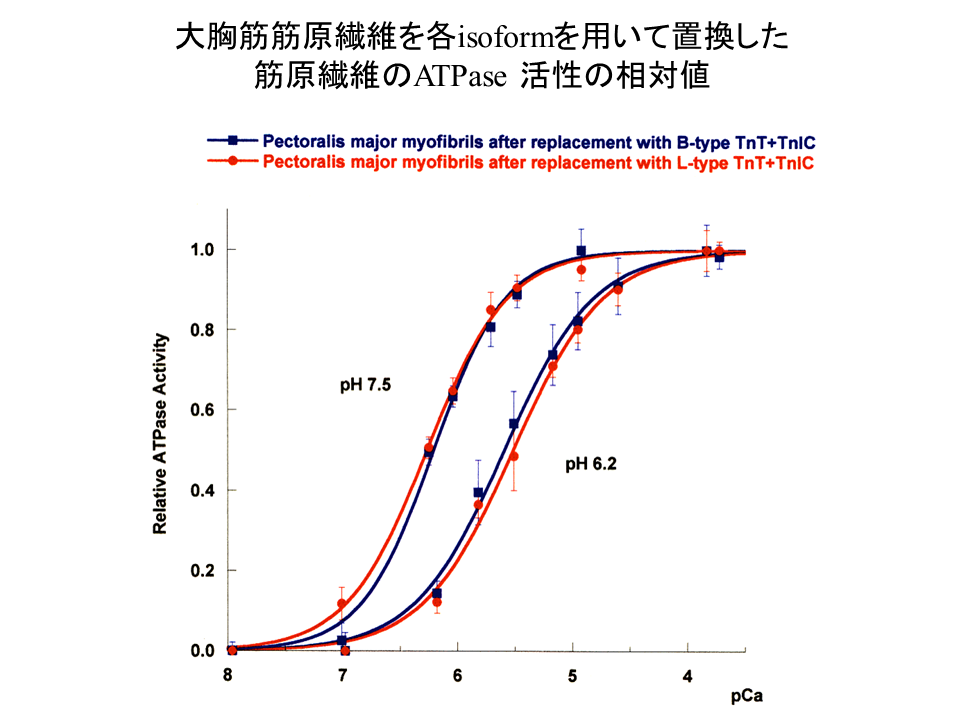
説明文の35
大胸筋筋原繊維を用いて、B型アイソフォームを含むトロポニン複合体(青色で示す)とL型アイソフォームを含むトロポニン複合体(赤色で示す)で置換して、pH6.2と7.5でATPase assayを行った。どちらのpHでも、pCaカーブは重ならなかった。
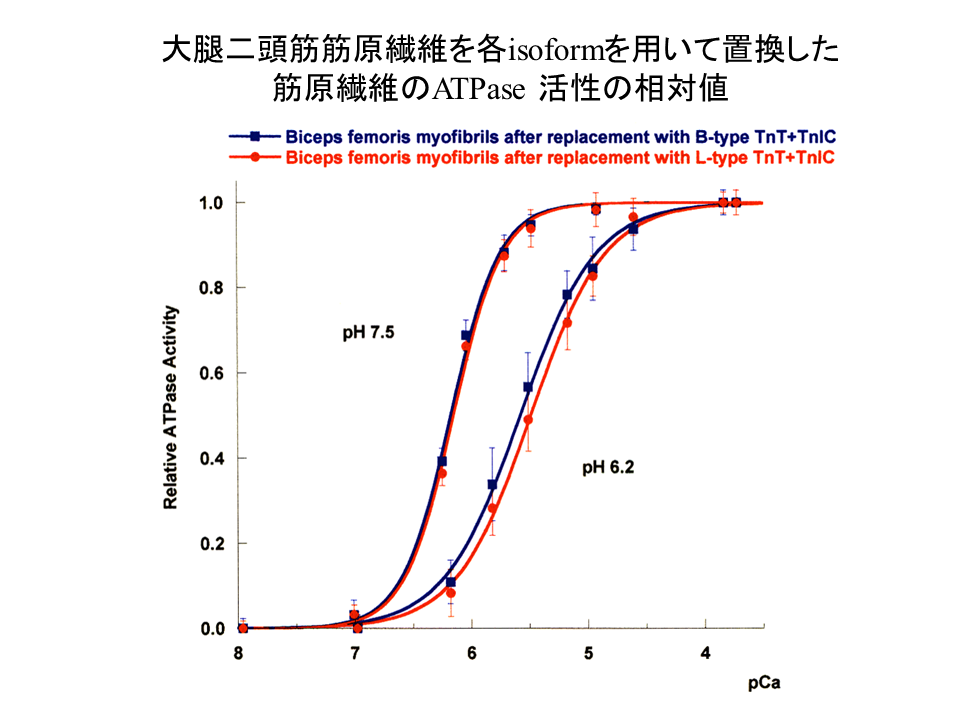
説明文の36
大腿二頭筋筋原繊維を用いて、B型アイソフォームを含むトロポニン複合体(青色で示す)とL型アイソフォームを含むトロポニン複合体(赤色で示す)で置換して、pH6.2と7.5でATPase assayを行った。pH7.5では、pCaカーブはほぼ重なったが、pH6.2ではpCaカーブは重ならなかった。
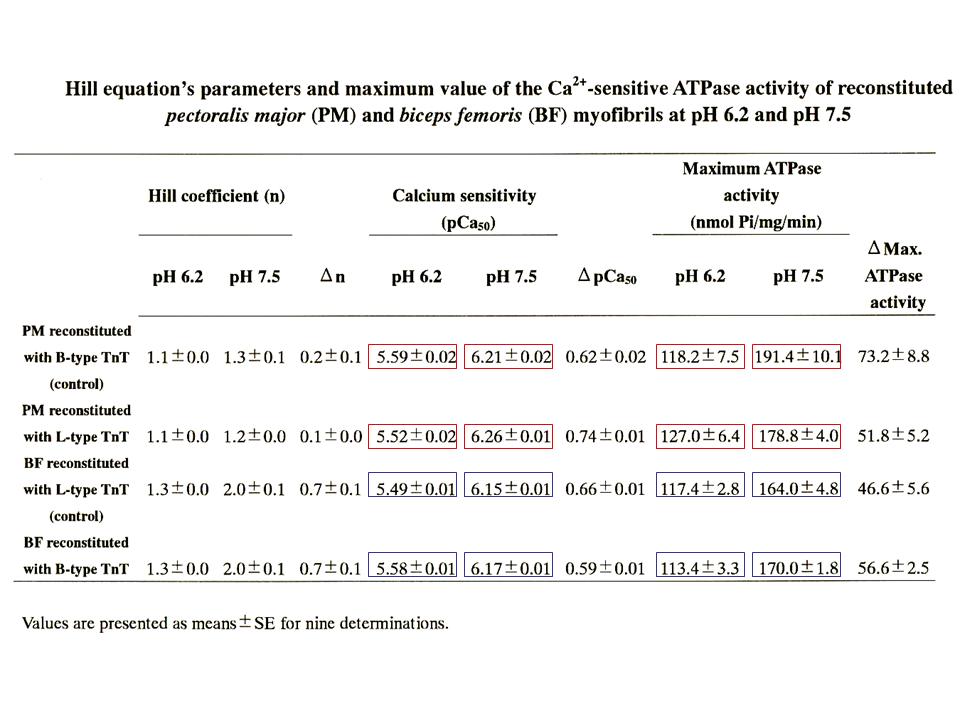
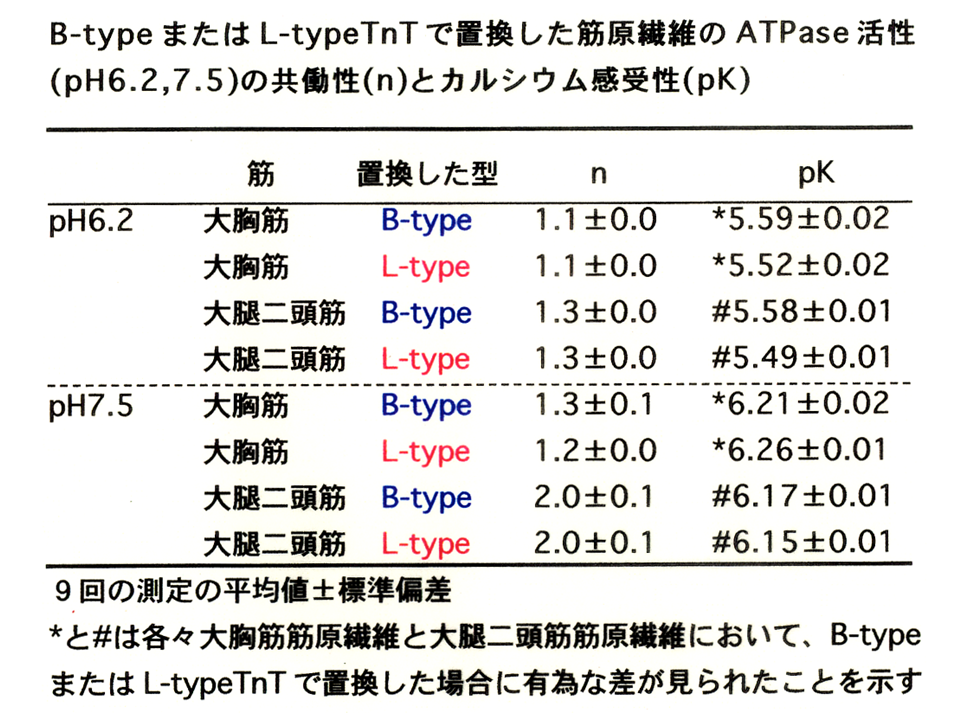
説明文の37
どちらのpHでもpCa50(上述ではpK)に、また、ATPase活性に、B型アイソフォームを含むトロポニン複合体とL型アイソフォームを含むトロポニン複合体で置換していた筋原繊維の間で差がみられた。
説明文の38
わかりやすくするために、別の形でデータを示すと、どちらのpHでもB型アイソフォームを含むトロポニン複合体で置換した方が、L型アイソフォームを含むトロポニン複合体で置換した場合より、pK(共働性)が高くなった。実際に筋細胞の中のpHがアルカリ性側の7.5になることはないが、筋肉疲労によって筋細胞中に乳酸がたまると(アシドーシス)、pHが酸性側の6.2になることがある。

説明文の39
pH7.0でATPase 活性を測定した際、B型とL型の間に機能の差は認められなかった、また、TnT-3、TnT-4、TnT4Mの間にも機能の差がみられなかった。それゆえ、TnTアイソフォームの間に機能の相違なく、トロポニンTに多様性がみられるのは機能的な冗長性(Functional Redundancy)のためである。しかし、pH6.2でATPase 活性を測定した際、B型はL型より高いカルシウム感受性を示した。したがって、 B型はL型より筋肉疲労(アシドーシス)に対しより高い耐性をもつと思われる。 このことは、TnTアイソフォームの間に機能の相違があり、それゆえ機能的特異性(Functional Specificity)のあることを示している。

説明文の40
pH7.0でATPase 活性を測定した際、B型とL型の間に機能の差は認められなかった、また、TnT-3、TnT-4、TnT4Mの間にも機能の差がみられなかった。それゆえ、TnTアイソフォームの間に機能の相違なく、トロポニンTに多様性がみられるのは機能的な冗長性(Functional Redundancy)のためである。しかし、pH6.2でATPase 活性を測定した際、B型はL型より高いカルシウム感受性を示した。したがって、 B型はL型より筋肉疲労(アシドーシス)に対しより高い耐性をもつと思われる。 このことは、TnTアイソフォームの間に機能の相違があり、それゆえ機能的特異性(Functional Specificity)のあることを示している。
